QUÍMICA GERAL I
Os lantanídeos e actinídeos foram desdobrados em duas séries, colocadas logo abaixo da tabela. Ao realizar as distribuições eletrônicas desses elementos o subnível mais energético será o “nf”. Ao realizar a distribuição eletrônica do 58Ce, podemos localiza-lo em que família e período, respectivamente?
Família dos lantanídeos e no 4º período.
Família dos actinídeos e no 6º período.
Família 4A e 6º período.
Família dos lantanídeos e no 6º período.
Família 6A e 6ºperíodo.
O último elétron de um átomo neutro apresenta o seguinte conjunto de números quânticos: n = 3; l = 1; m = 0; s = +1/2. Convencionando-se que o primeiro elétron a ocupar um orbital possui número quântico de spin igual a +1/2, o número atômico desse átomo é igual a:
17
15
13
16
14
O último elétron distribuído na configuração eletrônica de um átomo neutro, no estado fundamental, possui o seguinte conjunto de números quânticos: 4, 1, +1 e +1/2. Sabendo-se que esse átomo possui número de massa igual a 84 e que, por convenção, o primeiro elétron a ocupar um orbital possui número quântico de spin igual a 1/2, o número de nêutrons existentes no núcleo desse átomo é:
36
33
45
48
84
Após estudar as propriedade periódicas dos elementos químicos, um aluno fez a seguinte afirmação:
"A 1ª energia de ionização é medida pela energia ______________ quando o 1º elétron é retirado de um _____________ isolado. Para um mesmo elemento, a 2ª energia de ionização é _________________ do que a 1ª.
Assinale a alternativa correta, para completar, respectivamente, os espaços do texto:
liberada, íon positivo, menor.
absorvida, íon negativo, menor.
absorvida, íon positivo, menor.
liberada, átomo neutro, maior.
absorvida, átomo neutro, maior.
Um composto químico iônico foi representada pela fórmula X2Y. Sendo assim, na tabela periódica, é possível que X e Y se localizem, respectivamente, nas colunas:
1A e 2A.
2A e 7A.
2A e 1A.
2A e 5A.
1A e 6A.
As geometrias das moléculas de amônia, NH3, fluoreto de boro, BF3, gás carbônico, CO2 e fluoreto de enxofre, SF4, são respectivamente:
Piramidal, trigonal piramidal, linear e octaédrica.
Piramidal, trigonal plana, linear e gangorra.
Trigonal plana, trigonal plana, linear e octaédrica.
Piramidal, gangorra, angular e tetraédrica.
Trigonal plana, trigonal plana, angular e gangorra.
Após fazer diversos cálculos para obter a constante ácida de um composto, o número obtido foi 0,00000000008065 . Para esse resultado, o número de algarismo significativos é:
4
11
15
14
3
Ao preparar uma solução, um aluno adicionou certa quantidade de um soluto, a um solvente, obtendo a massa de 4000 g e 5 Litros de solução. Qual a densidade em g/cm3 dessa solução preparada?
8
0,08
80
800
0,8
As propriedades dos elementos químicos são responsáveis por várias características apresentadas pela matéria formada. A reatividade entre materiais, as ligações entre o átomos e compactação da matéria são apenas alguns exemplos de características dos materiais que sofrem influencia das propriedades periódicas e aperiódicas dos elementos químicos. Baseado nos temas estudados, assinale a afirmação correta.
Quanto maior for o caráter metálico de um elemento, maior será sua afinidade eletrônica.
Quando aumentamos do número de níveis de energia, o raio atômico, na mesma família, diminui.
Em um mesmo período, a primeira energia de ionização é sempre maior que a segunda.
Para elementos de uma mesma família, o volume atômico aumenta com o aumento do número de níveis de energia.
Para íons de elementos de transição, o número do grupo coincide com o número de níveis e subníveis de energia.
Considere um átomo que tenha a distribuição eletrônica abaixo e, adotando-se, por convenção, que o primeiro elétron distribuído assume o valor de spin igual a – 1/2. Qual alternativa contém os números quânticos que indicam a energia do elétron mais energético.
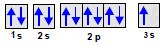
Família dos lantanídeos e no 4º período.
Família dos actinídeos e no 6º período.
Família 4A e 6º período.
Família dos lantanídeos e no 6º período.
Família 6A e 6ºperíodo.
O último elétron de um átomo neutro apresenta o seguinte conjunto de números quânticos: n = 3; l = 1; m = 0; s = +1/2. Convencionando-se que o primeiro elétron a ocupar um orbital possui número quântico de spin igual a +1/2, o número atômico desse átomo é igual a:
17
15
13
16
14
O último elétron distribuído na configuração eletrônica de um átomo neutro, no estado fundamental, possui o seguinte conjunto de números quânticos: 4, 1, +1 e +1/2. Sabendo-se que esse átomo possui número de massa igual a 84 e que, por convenção, o primeiro elétron a ocupar um orbital possui número quântico de spin igual a 1/2, o número de nêutrons existentes no núcleo desse átomo é:
36
33
45
48
84
Após estudar as propriedade periódicas dos elementos químicos, um aluno fez a seguinte afirmação:
"A 1ª energia de ionização é medida pela energia ______________ quando o 1º elétron é retirado de um _____________ isolado. Para um mesmo elemento, a 2ª energia de ionização é _________________ do que a 1ª.
Assinale a alternativa correta, para completar, respectivamente, os espaços do texto:
liberada, íon positivo, menor.
absorvida, íon negativo, menor.
absorvida, íon positivo, menor.
liberada, átomo neutro, maior.
absorvida, átomo neutro, maior.
Um composto químico iônico foi representada pela fórmula X2Y. Sendo assim, na tabela periódica, é possível que X e Y se localizem, respectivamente, nas colunas:
1A e 2A.
2A e 7A.
2A e 1A.
2A e 5A.
1A e 6A.
As geometrias das moléculas de amônia, NH3, fluoreto de boro, BF3, gás carbônico, CO2 e fluoreto de enxofre, SF4, são respectivamente:
Piramidal, trigonal piramidal, linear e octaédrica.
Piramidal, trigonal plana, linear e gangorra.
Trigonal plana, trigonal plana, linear e octaédrica.
Piramidal, gangorra, angular e tetraédrica.
Trigonal plana, trigonal plana, angular e gangorra.
Após fazer diversos cálculos para obter a constante ácida de um composto, o número obtido foi 0,00000000008065 . Para esse resultado, o número de algarismo significativos é:
4
11
15
14
3
Ao preparar uma solução, um aluno adicionou certa quantidade de um soluto, a um solvente, obtendo a massa de 4000 g e 5 Litros de solução. Qual a densidade em g/cm3 dessa solução preparada?
8
0,08
80
800
0,8
As propriedades dos elementos químicos são responsáveis por várias características apresentadas pela matéria formada. A reatividade entre materiais, as ligações entre o átomos e compactação da matéria são apenas alguns exemplos de características dos materiais que sofrem influencia das propriedades periódicas e aperiódicas dos elementos químicos. Baseado nos temas estudados, assinale a afirmação correta.
Quanto maior for o caráter metálico de um elemento, maior será sua afinidade eletrônica.
Quando aumentamos do número de níveis de energia, o raio atômico, na mesma família, diminui.
Em um mesmo período, a primeira energia de ionização é sempre maior que a segunda.
Para elementos de uma mesma família, o volume atômico aumenta com o aumento do número de níveis de energia.
Para íons de elementos de transição, o número do grupo coincide com o número de níveis e subníveis de energia.
Considere um átomo que tenha a distribuição eletrônica abaixo e, adotando-se, por convenção, que o primeiro elétron distribuído assume o valor de spin igual a – 1/2. Qual alternativa contém os números quânticos que indicam a energia do elétron mais energético.

17
15
13
16
14
O último elétron distribuído na configuração eletrônica de um átomo neutro, no estado fundamental, possui o seguinte conjunto de números quânticos: 4, 1, +1 e +1/2. Sabendo-se que esse átomo possui número de massa igual a 84 e que, por convenção, o primeiro elétron a ocupar um orbital possui número quântico de spin igual a 1/2, o número de nêutrons existentes no núcleo desse átomo é:
36
33
45
48
84
Após estudar as propriedade periódicas dos elementos químicos, um aluno fez a seguinte afirmação:
"A 1ª energia de ionização é medida pela energia ______________ quando o 1º elétron é retirado de um _____________ isolado. Para um mesmo elemento, a 2ª energia de ionização é _________________ do que a 1ª.
Assinale a alternativa correta, para completar, respectivamente, os espaços do texto:
liberada, íon positivo, menor.
absorvida, íon negativo, menor.
absorvida, íon positivo, menor.
liberada, átomo neutro, maior.
absorvida, átomo neutro, maior.
Um composto químico iônico foi representada pela fórmula X2Y. Sendo assim, na tabela periódica, é possível que X e Y se localizem, respectivamente, nas colunas:
1A e 2A.
2A e 7A.
2A e 1A.
2A e 5A.
1A e 6A.
As geometrias das moléculas de amônia, NH3, fluoreto de boro, BF3, gás carbônico, CO2 e fluoreto de enxofre, SF4, são respectivamente:
Piramidal, trigonal piramidal, linear e octaédrica.
Piramidal, trigonal plana, linear e gangorra.
Trigonal plana, trigonal plana, linear e octaédrica.
Piramidal, gangorra, angular e tetraédrica.
Trigonal plana, trigonal plana, angular e gangorra.
Após fazer diversos cálculos para obter a constante ácida de um composto, o número obtido foi 0,00000000008065 . Para esse resultado, o número de algarismo significativos é:
4
11
15
14
3
Ao preparar uma solução, um aluno adicionou certa quantidade de um soluto, a um solvente, obtendo a massa de 4000 g e 5 Litros de solução. Qual a densidade em g/cm3 dessa solução preparada?
8
0,08
80
800
0,8
As propriedades dos elementos químicos são responsáveis por várias características apresentadas pela matéria formada. A reatividade entre materiais, as ligações entre o átomos e compactação da matéria são apenas alguns exemplos de características dos materiais que sofrem influencia das propriedades periódicas e aperiódicas dos elementos químicos. Baseado nos temas estudados, assinale a afirmação correta.
Quanto maior for o caráter metálico de um elemento, maior será sua afinidade eletrônica.
Quando aumentamos do número de níveis de energia, o raio atômico, na mesma família, diminui.
Em um mesmo período, a primeira energia de ionização é sempre maior que a segunda.
Para elementos de uma mesma família, o volume atômico aumenta com o aumento do número de níveis de energia.
Para íons de elementos de transição, o número do grupo coincide com o número de níveis e subníveis de energia.
Considere um átomo que tenha a distribuição eletrônica abaixo e, adotando-se, por convenção, que o primeiro elétron distribuído assume o valor de spin igual a – 1/2. Qual alternativa contém os números quânticos que indicam a energia do elétron mais energético.

36
33
45
48
84
Após estudar as propriedade periódicas dos elementos químicos, um aluno fez a seguinte afirmação:
"A 1ª energia de ionização é medida pela energia ______________ quando o 1º elétron é retirado de um _____________ isolado. Para um mesmo elemento, a 2ª energia de ionização é _________________ do que a 1ª.
Assinale a alternativa correta, para completar, respectivamente, os espaços do texto:
liberada, íon positivo, menor.
absorvida, íon negativo, menor.
absorvida, íon positivo, menor.
liberada, átomo neutro, maior.
absorvida, átomo neutro, maior.
Um composto químico iônico foi representada pela fórmula X2Y. Sendo assim, na tabela periódica, é possível que X e Y se localizem, respectivamente, nas colunas:
1A e 2A.
2A e 7A.
2A e 1A.
2A e 5A.
1A e 6A.
As geometrias das moléculas de amônia, NH3, fluoreto de boro, BF3, gás carbônico, CO2 e fluoreto de enxofre, SF4, são respectivamente:
Piramidal, trigonal piramidal, linear e octaédrica.
Piramidal, trigonal plana, linear e gangorra.
Trigonal plana, trigonal plana, linear e octaédrica.
Piramidal, gangorra, angular e tetraédrica.
Trigonal plana, trigonal plana, angular e gangorra.
Após fazer diversos cálculos para obter a constante ácida de um composto, o número obtido foi 0,00000000008065 . Para esse resultado, o número de algarismo significativos é:
4
11
15
14
3
Ao preparar uma solução, um aluno adicionou certa quantidade de um soluto, a um solvente, obtendo a massa de 4000 g e 5 Litros de solução. Qual a densidade em g/cm3 dessa solução preparada?
8
0,08
80
800
0,8
As propriedades dos elementos químicos são responsáveis por várias características apresentadas pela matéria formada. A reatividade entre materiais, as ligações entre o átomos e compactação da matéria são apenas alguns exemplos de características dos materiais que sofrem influencia das propriedades periódicas e aperiódicas dos elementos químicos. Baseado nos temas estudados, assinale a afirmação correta.
Quanto maior for o caráter metálico de um elemento, maior será sua afinidade eletrônica.
Quando aumentamos do número de níveis de energia, o raio atômico, na mesma família, diminui.
Em um mesmo período, a primeira energia de ionização é sempre maior que a segunda.
Para elementos de uma mesma família, o volume atômico aumenta com o aumento do número de níveis de energia.
Para íons de elementos de transição, o número do grupo coincide com o número de níveis e subníveis de energia.
Considere um átomo que tenha a distribuição eletrônica abaixo e, adotando-se, por convenção, que o primeiro elétron distribuído assume o valor de spin igual a – 1/2. Qual alternativa contém os números quânticos que indicam a energia do elétron mais energético.

liberada, íon positivo, menor.
absorvida, íon negativo, menor.
absorvida, íon positivo, menor.
liberada, átomo neutro, maior.
absorvida, átomo neutro, maior.
Um composto químico iônico foi representada pela fórmula X2Y. Sendo assim, na tabela periódica, é possível que X e Y se localizem, respectivamente, nas colunas:
1A e 2A.
2A e 7A.
2A e 1A.
2A e 5A.
1A e 6A.
As geometrias das moléculas de amônia, NH3, fluoreto de boro, BF3, gás carbônico, CO2 e fluoreto de enxofre, SF4, são respectivamente:
Piramidal, trigonal piramidal, linear e octaédrica.
Piramidal, trigonal plana, linear e gangorra.
Trigonal plana, trigonal plana, linear e octaédrica.
Piramidal, gangorra, angular e tetraédrica.
Trigonal plana, trigonal plana, angular e gangorra.
Após fazer diversos cálculos para obter a constante ácida de um composto, o número obtido foi 0,00000000008065 . Para esse resultado, o número de algarismo significativos é:
4
11
15
14
3
Ao preparar uma solução, um aluno adicionou certa quantidade de um soluto, a um solvente, obtendo a massa de 4000 g e 5 Litros de solução. Qual a densidade em g/cm3 dessa solução preparada?
8
0,08
80
800
0,8
As propriedades dos elementos químicos são responsáveis por várias características apresentadas pela matéria formada. A reatividade entre materiais, as ligações entre o átomos e compactação da matéria são apenas alguns exemplos de características dos materiais que sofrem influencia das propriedades periódicas e aperiódicas dos elementos químicos. Baseado nos temas estudados, assinale a afirmação correta.
Quanto maior for o caráter metálico de um elemento, maior será sua afinidade eletrônica.
Quando aumentamos do número de níveis de energia, o raio atômico, na mesma família, diminui.
Em um mesmo período, a primeira energia de ionização é sempre maior que a segunda.
Para elementos de uma mesma família, o volume atômico aumenta com o aumento do número de níveis de energia.
Para íons de elementos de transição, o número do grupo coincide com o número de níveis e subníveis de energia.
Considere um átomo que tenha a distribuição eletrônica abaixo e, adotando-se, por convenção, que o primeiro elétron distribuído assume o valor de spin igual a – 1/2. Qual alternativa contém os números quânticos que indicam a energia do elétron mais energético.

1A e 2A.
2A e 7A.
2A e 1A.
2A e 5A.
1A e 6A.
As geometrias das moléculas de amônia, NH3, fluoreto de boro, BF3, gás carbônico, CO2 e fluoreto de enxofre, SF4, são respectivamente:
Piramidal, trigonal piramidal, linear e octaédrica.
Piramidal, trigonal plana, linear e gangorra.
Trigonal plana, trigonal plana, linear e octaédrica.
Piramidal, gangorra, angular e tetraédrica.
Trigonal plana, trigonal plana, angular e gangorra.
Após fazer diversos cálculos para obter a constante ácida de um composto, o número obtido foi 0,00000000008065 . Para esse resultado, o número de algarismo significativos é:
4
11
15
14
3
Ao preparar uma solução, um aluno adicionou certa quantidade de um soluto, a um solvente, obtendo a massa de 4000 g e 5 Litros de solução. Qual a densidade em g/cm3 dessa solução preparada?
8
0,08
80
800
0,8
As propriedades dos elementos químicos são responsáveis por várias características apresentadas pela matéria formada. A reatividade entre materiais, as ligações entre o átomos e compactação da matéria são apenas alguns exemplos de características dos materiais que sofrem influencia das propriedades periódicas e aperiódicas dos elementos químicos. Baseado nos temas estudados, assinale a afirmação correta.
Quanto maior for o caráter metálico de um elemento, maior será sua afinidade eletrônica.
Quando aumentamos do número de níveis de energia, o raio atômico, na mesma família, diminui.
Em um mesmo período, a primeira energia de ionização é sempre maior que a segunda.
Para elementos de uma mesma família, o volume atômico aumenta com o aumento do número de níveis de energia.
Para íons de elementos de transição, o número do grupo coincide com o número de níveis e subníveis de energia.
Considere um átomo que tenha a distribuição eletrônica abaixo e, adotando-se, por convenção, que o primeiro elétron distribuído assume o valor de spin igual a – 1/2. Qual alternativa contém os números quânticos que indicam a energia do elétron mais energético.

Piramidal, trigonal piramidal, linear e octaédrica.
Piramidal, trigonal plana, linear e gangorra.
Trigonal plana, trigonal plana, linear e octaédrica.
Piramidal, gangorra, angular e tetraédrica.
Trigonal plana, trigonal plana, angular e gangorra.
Após fazer diversos cálculos para obter a constante ácida de um composto, o número obtido foi 0,00000000008065 . Para esse resultado, o número de algarismo significativos é:
4
11
15
14
3
Ao preparar uma solução, um aluno adicionou certa quantidade de um soluto, a um solvente, obtendo a massa de 4000 g e 5 Litros de solução. Qual a densidade em g/cm3 dessa solução preparada?
8
0,08
80
800
0,8
As propriedades dos elementos químicos são responsáveis por várias características apresentadas pela matéria formada. A reatividade entre materiais, as ligações entre o átomos e compactação da matéria são apenas alguns exemplos de características dos materiais que sofrem influencia das propriedades periódicas e aperiódicas dos elementos químicos. Baseado nos temas estudados, assinale a afirmação correta.
Quanto maior for o caráter metálico de um elemento, maior será sua afinidade eletrônica.
Quando aumentamos do número de níveis de energia, o raio atômico, na mesma família, diminui.
Em um mesmo período, a primeira energia de ionização é sempre maior que a segunda.
Para elementos de uma mesma família, o volume atômico aumenta com o aumento do número de níveis de energia.
Para íons de elementos de transição, o número do grupo coincide com o número de níveis e subníveis de energia.
Considere um átomo que tenha a distribuição eletrônica abaixo e, adotando-se, por convenção, que o primeiro elétron distribuído assume o valor de spin igual a – 1/2. Qual alternativa contém os números quânticos que indicam a energia do elétron mais energético.

4
11
15
14
3
Ao preparar uma solução, um aluno adicionou certa quantidade de um soluto, a um solvente, obtendo a massa de 4000 g e 5 Litros de solução. Qual a densidade em g/cm3 dessa solução preparada?
8
0,08
80
800
0,8
As propriedades dos elementos químicos são responsáveis por várias características apresentadas pela matéria formada. A reatividade entre materiais, as ligações entre o átomos e compactação da matéria são apenas alguns exemplos de características dos materiais que sofrem influencia das propriedades periódicas e aperiódicas dos elementos químicos. Baseado nos temas estudados, assinale a afirmação correta.
Quanto maior for o caráter metálico de um elemento, maior será sua afinidade eletrônica.
Quando aumentamos do número de níveis de energia, o raio atômico, na mesma família, diminui.
Em um mesmo período, a primeira energia de ionização é sempre maior que a segunda.
Para elementos de uma mesma família, o volume atômico aumenta com o aumento do número de níveis de energia.
Para íons de elementos de transição, o número do grupo coincide com o número de níveis e subníveis de energia.
Considere um átomo que tenha a distribuição eletrônica abaixo e, adotando-se, por convenção, que o primeiro elétron distribuído assume o valor de spin igual a – 1/2. Qual alternativa contém os números quânticos que indicam a energia do elétron mais energético.

8
0,08
80
800
0,8
As propriedades dos elementos químicos são responsáveis por várias características apresentadas pela matéria formada. A reatividade entre materiais, as ligações entre o átomos e compactação da matéria são apenas alguns exemplos de características dos materiais que sofrem influencia das propriedades periódicas e aperiódicas dos elementos químicos. Baseado nos temas estudados, assinale a afirmação correta.
Quanto maior for o caráter metálico de um elemento, maior será sua afinidade eletrônica.
Quando aumentamos do número de níveis de energia, o raio atômico, na mesma família, diminui.
Em um mesmo período, a primeira energia de ionização é sempre maior que a segunda.
Para elementos de uma mesma família, o volume atômico aumenta com o aumento do número de níveis de energia.
Para íons de elementos de transição, o número do grupo coincide com o número de níveis e subníveis de energia.
Considere um átomo que tenha a distribuição eletrônica abaixo e, adotando-se, por convenção, que o primeiro elétron distribuído assume o valor de spin igual a – 1/2. Qual alternativa contém os números quânticos que indicam a energia do elétron mais energético.

Quanto maior for o caráter metálico de um elemento, maior será sua afinidade eletrônica.
Quando aumentamos do número de níveis de energia, o raio atômico, na mesma família, diminui.
Em um mesmo período, a primeira energia de ionização é sempre maior que a segunda.
Para elementos de uma mesma família, o volume atômico aumenta com o aumento do número de níveis de energia.
Para íons de elementos de transição, o número do grupo coincide com o número de níveis e subníveis de energia.